
Εικόνα 16. Ενεργός οξύτητα - Παραδείγματα ουσιών με διαφορετικές τιμές pH
Η ενεργός οξύτητα εκφράζει τη συγκέντρωση των κατιόντων υδρογόνου (υδρογονιόντων) ενός δείγματος. Το pH ενός δείγματος ισούται με την αρνητική λογαριθμική συγκέντρωση των ιόντων υδρογόνου στο δείγμα (-log[H+]). Η κλίμακα μέτρησης του pH είναι από 0 ως 14. Η τιμή 7 αντιστοιχεί σε ουδέτερα δείγματα. Τιμές μικρότερες του 7 υποδεικνύουν υπεροχή υδρογονιόντων (οξύτητα) στο δείγμα, ενώ τιμές μεγαλύτερες από 7 αντιστοιχούν σε αλκαλικά δείγματα (υπεροχή υδροξυλιόντων) - εικ 16.
Εικόνα 16. Ενεργός οξύτητα - Παραδείγματα ουσιών με διαφορετικές τιμές pH

Εικόνα 16.
Ενεργός οξύτητα - Παραδείγματα ουσιών με διαφορετικές τιμές pH
Το σύνολο των βιοχημικών αντιδράσεων στο εσωτερικό των κυττάρων πραγματοποιείται σε ουδέτερο pH. Όξινα ή αλκαλικά περιβάλλοντα δυσχεραίνουν την πορεία των παραπάνω αντιδράσεων ή αναστέλλουν την πραγματοποίησή τους.
Τα φυσικά νερά έχουν τιμές pH που κυμαίνονται μεταξύ των 4-9 μονάδων, ενώ τιμές 6,5-8,5 είναι στις περισσότερες περιπτώσεις οι καταλληλότερες για τους υδρόβιους οργανισμούς. Η ενεργός οξύτητα του νερού εξαρτάται από τη θερμοκρασία, την αλατότητα (παρουσία ανιόντων θείου, χλωρίου κ.ά., μεταλλικών κατιόντων ασβεστίου, μαγνησίου κ.ά.), τις συγκεντρώσεις του διοξειδίου του άνθρακα και του οξυγόνου, καθώς και από τη μεταβολική δραστηριότητα των υδρόβιων οργανισμών (φωτοσύνθεση, αναπνοή) και τη χημική αποσύνθεση των οργανικών ουσιών (εικ. 17).

Εικόνα 17. Παράγοντες που επηρεάζουν το pH του νερού
μιας λίμνης- Όργανα μέτρησης του pH.
Το CO2 διαλύεται εύκολα στο νερό συμβάλλοντας στη διαμόρφωση
ενός περιβάλλοντος κατάλληλου για τη ζωή, δεδομένου ότι συμμετέχει στις διαδικασίες
φωτοσύνθεσης και αναπνοής και αποτελεί ουσιαστική πηγή άνθρακα, άμεσα ή έμμεσα,
για τις ενεργειακές απαιτήσεις των οργανισμών. Η διαλυτότητα του CO2
στο νερό προσδιορίζεται από τις παρακάτω αντιδράσεις:
CO2
+ H2O - H2CO3
CO2 + OH- - HCO3-
και στη συνέχεια:
H2CO3 - Η+ + HCO3-
HCO3- - Η+ + CO3=
Αύξηση της συγκέντρωσης του CO2 προκαλεί μείωση του pH και αντίστροφα. Η κατακόρυφη κατανομή του pH καθορίζεται από τη δέσμευση του CO2 (στα στρώματα όπου συναντώνται οι φωτοσυνθετικοί οργανισμοί) και την απελευθέρωσή του κατά την αναπνοή σε όλα τα βάθη της υδάτινης στήλης. Κατά τις περιόδους στρωμάτωσης μιας λίμνης, παρατηρούνται προοδευτικές μεταβολές στις τιμές του pH. Οι μεταβολές αυτές οφείλονται συνήθως στην κατανάλωση CO2 (συνεπώς αύξηση του pH) στο επιλίμνιο, εξαιτίας της φωτοσυνθετικής δραστηριότητας, και στην απελευθέρωσή του στο υπολίμνιο (συνεπώς μείωση του pH), κατά την αποσύνθεση κυρίως νεκρών πλαγκτονικών οργανισμών και οργανικού υλικού του πυθμένα (εικ. 18).
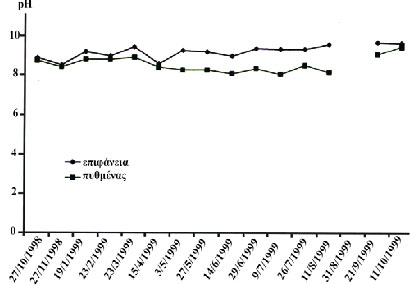
Εικόνα
18. Αυξομειώσεις στο pH του νερού της λίμνης της Καστοριάς στη διάρκεια
ενός έτους
Οι περισσότερες λίμνες παρουσιάζουν μεγάλη ρυθμιστική ικανότητα, ανθίστανται δηλαδή, μέσω μιας σειράς χημικών αντιδράσεων που συμβαίνουν στο εσωτερικό τους, σε απότομες μεταβολές του pH.
Σημαντικές και σχετικά μόνιμες μεταβολές στο pH παρατηρούνται συνήθως κάτω από την επίδραση εξωγενών παραγόντων. Χαμηλές τιμές του pH οφείλονται συχνά στην εισαγωγή οξέων στη λίμνη (όξινη βροχή, αστικά και βιομηχανικά απόβλητα κ.ά.). Εμπλουτισμός της λίμνης με θειικά οξέα συμβαίνει με τη βροχή (το νερό της βροχής περιέχει, μεταξύ άλλων ανιόντων, SO4=) ή μπορεί να οφείλεται στη σύσταση του υπεδάφους της λεκάνης απορροής. Η έκθεση στον ατμοσφαιρικό αέρα πετρωμάτων τύρφης του υπεδάφους (λόγω διάβρωσης του εδάφους) αυξάνει τη συγκέντρωση του θειικού οξέος στο νερό της λίμνης. Η οξείδωση του πυρίτη (FeS2), συστατικό των πετρωμάτων τύρφης, καταλήγει στο σχηματισμό θειικού οξέος.
Αλκαλικές τιμές pH συναντάμε σε περιπτώσεις έντονης φωτοσυνθετικής δραστηριότητας - ευτροφισμός (κατά τη φωτοσύνθεση το φυτοπλαγκτόν μειώνει τη συγκέντρωση του CO2 του νερού), σε περιπτώσεις ρύπανσης της λίμνης με αλκαλικές ουσίες (απορρυπαντικά κ.ά. από αστικά και βιομηχανικά απόβλητα) και σε αυξημένες συγκεντρώσεις ασβεστίου, νατρίου και μαγνησίου.
Εμπλουτισμός της λίμνης με ιόντα ασβεστίου παρατηρείται σε περιοχές όπου στη λεκάνη απορροής επικρατούν ασβεστολιθικά πετρώματα. Το νερό της βροχής μεταφέρει στη λίμνη ιόντα ασβεστίου, που δεσμεύει κατά τη ροή του πάνω από τα ασβεστολιθικά πετρώματα, τα οποία αντιδρούν με τα όξινα ανθρακικά ιόντα HCO3- του νερού της λίμνης σχηματίζοντας αδιάλυτο ανθρακικό ασβέστιο που κατακρημνίζεται. Η απομάκρυνση HCO3- από το νερό αυξάνει το pH του νερού. Οι παρακάτω αντιδράσεις περιγράφουν το φαινόμενο:
H2CO3 + CaCO3
> Ca2+ + 2HCO3-
Ca2+
+ 2HCO3- - Ca(HCO3)2
> CaCO3 v + H2O + CO2
Μέτρηση pH
Η μέτρηση του pH είναι μία από τις σημαντικότερες μετρήσεις κατά την αξιολόγηση της ποιότητας του νερού ενός λιμναίου οικοσυστήματος. Το pH μπορεί να μετρηθεί ηλεκτρομετρικά (πεχάμετρο), χρωματομετρικά (χρησιμοποίηση δεικτών που αλλάζουν χρώμα σε διαφορετικές τιμές pH), με χρήση φασματοφωτόμετρου κ.ά.